 PR
PR2026.01.19
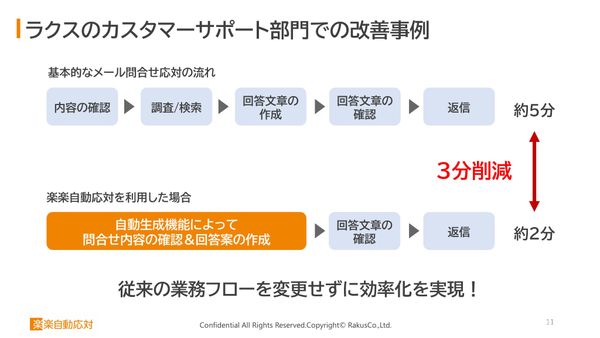
業務フローを変えずに、メール1通3分を削減 自動でAIにナレッジが貯まる問い合わせシステム「楽楽自動応対」
How Close Are We to Curing Alzheimer's?(全1記事)
コピーリンクをコピー
ブックマーク記事をブックマーク
しかし、加齢による困った問題もたくさんあります。その中で大きなものが、認知症リスクの上昇です。
アルツハイマー病など認知症については、一般的に、年を取れば普通にかかってしまう、避けられない形の認知症だと思われているようです。しかし、こういった疾患について、脳内で起こるすべてが明らかになってはいませんが、予防や治療は不可能ではありません。
そのため、研究者たちは、必死になって認知症のメカニズムを解明し、治療法や予防法を探しています。新たな研究成果も絶えず発表されています。しかし、まだまだ道半ばであることは確かです。
同列に語られることの多いアルツハイマー病と認知症ですが、両者はまったく異なるものです。さらに、双方とも加齢はもっとも大きな因子ではありますが、年をとれば必ずかかるものでもありません。
認知症とは、複数の症状の症候群を指す広義の症状であり、単独かつ特定の疾患を示すものではありません。認知症では、認知と記憶に幅広い障害が起こります。言語力や理解力、学習力に問題が発生し、遂行機能障害、社会的行動障害が起こります。通常は徐々に進行し、多くが患者が自立生活を送れない状況に陥ります。
発症の原因はさまざまです。1つの例が「血管性認知症」です。これは、脳梗塞や、もっと小さな脳血栓など、脳内の血流異常から発症する症状です。
もう1つのよくある例は、α-シヌクレインというたんぱく質が、患者の脳内に蓄積し発症するものです。レビー小体型認知症として知られ、パーキンソン病と似たような症状が出ることがあります。
前頭側頭型認知症もあります。これは、脳の前頭葉と側頭葉が萎縮して発症します。また、遺伝的要因が大きいことがわかっていますが、何が要因なのかを特定することはまだ困難です。
認知症の50%から80%を占める、最大のケースは、100年以上前に発見されたアルツハイマー型認知症です。
大抵の認知症がそうであるように、アルツハイマー型認知症もまた、時とともに進行します。はじめは、近しい友人や家族でも気づかない程度の、軽い物忘れや集中力の低下から始まります。
症状が進行すると、より物忘れが激しくなり、人格や感情に変化が見られます。最終的には、患者は身の周りのことがほとんどできなくなり、周囲を認識できず、家族の顔がわからなくなり、24時間のケアが必要となります。研究者たちが、アルツハイマー病の解明に対し懸命に取り組んでいるのは、このためです。
発症してからの患者の平均寿命は8年です。死因はさまざまですが、症状が進んで、食物の摂取や心拍などの基本的な機能に影響をおよぼし、感染症や心筋梗塞を引き起こしやすくなることが多いです。
現在、アルツハイマー病の決定的要因はわかっていませんが、患者の脳内には2つの大きな特徴が見られることがわかっています。まず、アミロイドβからなるたんぱく質の堆積物である、プラーク(注:、脳の大脳皮質などに染み出るようにできる「老人斑」)が見られます。
もう1つは、ニューロン内で凝縮(注:「神経原繊維変化」)する、別のたんぱく質、タウです。
プラークも凝縮も、加齢とともに普通に起こるものですが、アルツハイマー病の患者にはとくに多く発生します。そして、症状の進行とともに脳内に広がるのです。そのため、医師たちは、これらのたんぱく質が、症状に関係があるに違いないと考えています。
現在、一番有力なのは「アミロイド仮説」です。これは、アミロイドβの蓄積をアルツハイマー病の主な原因とするものです。具体的には未解明ですが、プラークが脳細胞間の信号伝達を妨げます。
また、アミロイドβは、凝り固まってプラークを形成する以外にも、脳脊髄液に溶けやすい線維を形成します。免疫システムがこれを排除しようとすると、有害な炎症を引き起こすのです。
仮にアミロイド仮説が正しいとしても、アルツハイマー病の原因となるのは、アミロイドだけではありません。アミロイドのプラークが形成されると、タウたんぱく質が凝縮し、さらにダメージを加えます。
本来のタウたんぱく質の役割は、微小管(注:神経が細胞内に栄養分や神経伝達物質を運搬する)を結合する働きをします。しかしタウたんぱく質が本来の役割を放棄し、凝縮してしまうと、それまでとは逆に、分子の伝達を阻害します。つまり、玉突き事故が起きるだけでなく、道路そのものが地滑りで消失してしまうようなものです。

アミロイド、炎症、凝縮といったプロセスが、脳内のさまざまなシステムを阻害し、患者の記憶と認知機能は悪化していくのです。
しかも残念なことに、これらを回復させる手段は、いまだ解明されていません。そもそも、プラークや凝縮が発生する原因も、確定してはいないのです。
多くの研究者が、アルツハイマー病は、遺伝や全身の健康状態、環境など、複数の因子が絡み合って発症すると考えています。しかし、遺伝によりアルツハイマー病が出るケースが1つだけあります。
アルツハイマー病のうち1%は、PSEN1(プレセニリン1)、PSEN2(プレセニリン2)、アミロイドβの構成因子であるAPP(アミロイド前駆たんぱく質)などの、遺伝子の変異により発症します。1つでも変異した遺伝子を受け継いでしまうと、家族性アルツハイマー病を発症します。このケースの発症は比較的に若年時で、60代以降ではなく、40代から50代です。
いずれの発症原因であっても、アルツハイマー病と認知症には、治療法が見つかっていません。しかし少なくとも、進行を緩和させる治療の選択肢はあります。
アルツハイマー病に特化した医薬品は2種類あります。アセチルコリンエステラーゼ阻害剤とNMDA受容体の拮抗薬です。
阻害薬は、脳内の神経伝達物質であるアセチルコリンを分解してしまう酵素を阻害することにより、アセチルコリン量を増やし、アルツハイマー病の症状を緩和することができます。この酵素はプラークや凝縮の生成も促進すると考えられているため、阻害すれば、こういったプロセスの進行も緩和することができるかもしれません。

拮抗薬は、脳を興奮させる神経伝達物質である、グルタミン酸の活動を抑えます。グルタミン酸量を抑えて、過剰に興奮した神経の過活動を抑えることにより、症状を抑えることができるようです。

さて、こういった医薬品は、アルツハイマー病の進行を緩和することはできますが、進行を止めたり、元の状態に回復させたりすることはできません。その手段は、まだ解明されていないのです。
また、 脳血管性認知症(注:脳梗塞や脳出血などによって発症する認知症)などの、アルツハイマー病以外の認知症についても、治療薬はありません。こういった認知症患者には、アルツハイマー病の治療薬を投与することもできますが、効果が芳しくないため、医師たちは他のオプションを研究中です。
アルツハイマー病以外の認知症については、開発中の新薬やすでにある医薬品で、それぞれの認知症の特徴に合わせた臨床試験が行われています。
例えば、 脳血管性認知症であれば、脳内の血流を治療する薬品だったりします。少なくとも、そのうちの1つは、プラセボ対照試験において認知機能低下を緩和させる効果が認められているようですが、総体的な成果は明確ではありません。
今日までの研究は、アルツハイマー病治療の新薬開発にフォーカスされており、その医薬品が、他の認知症の治療薬として承認を受けている状況です。
アルツハイマー病の治療薬は、その多くがアミロイドβにフォーカスしています。現在、新薬開発で一番注目されているツールは、体外から侵入するたんぱく質を迎撃する、Y型をした分子、抗体です。アミロイドβの蓄積がアルツハイマー病の問題点であるため、このアミロイドβを体外に排出する抗体を作ってしまおうというのです。
これらの医薬品は生体物質であるため、「バイオ医薬品」としてこれらの薬品について聞いたことのある人もいるかもしれませんね。これらの医薬品は、ガンの治療薬としても臨床試験が行われています。
臨床試験が行われている抗体の1つが、「アデュカヌマブ」です。この抗体は、プラークとして蓄積される前に、アミロイドβの小塊と結合します。現在「アデュカヌマブ」は、世に出る前で、治験の最終段階にあります。
2016年の研究では、この抗体による治験参加者のアミロイド堆積の減少が、脳スキャン画像で確認されたとしています。最終試験でうまく効果が上がれば、これは画期的なことです。現行の研究成果は、2019年に発表されるはずです。
残念なことに、いくつかのバイオ医薬品は、すでに失敗しています。治験段階ではよくあることで、シャーレ上ではうまくいっても、人間に効果があるとは限らないのです。そのため、バイオ医薬品以外でも、さまざまな戦略で、多くの研究がなされています。
その1つが、アミロイドβ生成を促進する酵素、βセクレターゼなどを、「低分子医薬品」でブロックしてしまおうというものです。
「低分子医薬品」と呼ばれてはいますが、実際はかなり大きめの薬品で、単にたんぱく質などと比較すれば小さい、という意味です。低分子医薬品のうちいくつかについては、ごく初期の人体実験が行われていますが、一般への公開にはまだまだの段階です。
また、アミロイドではなく、タウをターゲットとして開発段階にある医薬品もあります。その一つが、タウワクチンAADvac1です。2015年、185人の被験者に開始した治験は、2019年2月に終了する予定です。
ワクチンと聞くと、不思議に思うかもしれませんが、バイオ医薬品とアプローチは似ています。バイオ医薬品は、特定のたんぱく質を攻撃する抗体を患者に投与します。ワクチンは、患者の身体に抗体を作り出す刺激を与えるのです。
たいへん興味深いアイデアではありますが、現時点では、なんらかの研究の成果が出ない限り、実現性はありません。
治療法を探すほかにも、アルツハイマーの原因をより明快に突き止める研究も行われています。病気の症状は、患者が死亡するはるか以前から確認できるにもかかわらず、プラークや凝縮を正確に診断するには、解剖する以外にないからです。
医師が疾病の存在を確認できる因子、つまりバイオマーカーを見つけることも、大きな目標の1つです。信頼性の高い患者を被験者として見つけることができる点において、他の研究でも役に立ちます。
ところで、治験においての課題は、いくら医薬品の開発が早くても、承認され医薬品として完成するまでには、長い時間がかかることです。実験室で薬効が確認できたとしても、実際に人間に効くことを確認する必要があります。
さらに、効力よりも害の方が大きいなどということは、あってはなりません。このように、非常に時間がかかるため、新薬が毎週のように出されるなどということは、滅多にありません。
さらに、すでに多くの研究がなされている中で、研究者たちは、今まで以上に効力の高い医薬品を追い求めています。治験段階で失敗した薬品は、みなさんが考えている以上にたくさんあります。そして、その理由もたくさんあります。
まず、脳はたいへん複雑な器官であるため、こういった中枢神経系に関わる医薬品の開発が困難であることは、広く知られています。さらに、小規模な試験段階で有望視されていた医薬品が、試験の規模が大きくなると失敗することは、よくあります。また、アルツハイマー病の試験に必要な患者の十分な頭数を揃えるのは、非常に難しいことなのです。
そして、こういった失敗すべての最も大きな原因は、そもそもの研究対象が見当違いの可能性があることです。アミロイド仮説を立証できる根拠はあるのですが、新薬開発に失敗続きであることは、ひょっとすれば、この仮説が間違っている証拠なのかもしれません。
アルツハイマー病の原因はアミロイドではなく、脳内のDNAダメージの累積や、細胞周期のトラブル、ニューロンを部分的に覆う脂肪の鞘(注:「髄鞘 (ずいしょう)」)の消滅など、加齢によるものだと主張する、この分野の有名な専門家もいますが、確証を得るためには、もう少し裏付けが必要でしょう。
ほとんどの研究者たちは、アミロイド仮説を捨てることができないでいますが、今後も検討する価値はありそうです。いずれにせよ現時点では、我々には研究を続けるしかなさそうです。実験や治療がうまくいかなかったとしても、それはそれで進歩だからです。
それまでは、医師や介護者たちが、症状に合った投薬や、日常生活の適切なルーティンなどを行って、できるかぎり患者やその家族が快適な生活を送れるように努力を続けています。一日の終わりには、すべてのアルツハイマー病や認知症の患者たちが、適切な支援を受けているべきだからです。いつか、この2つの病気が、根治されることを願ってやみません。
 Hank Green(ハンク・グリーン)たちがサイエンスに関する話題をわかりやすく解説するYouTubeチャンネル。 ・公式チャンネル
Hank Green(ハンク・グリーン)たちがサイエンスに関する話題をわかりやすく解説するYouTubeチャンネル。 ・公式チャンネル続きを読むには会員登録
(無料)が必要です。
会員登録していただくと、すべての記事が制限なく閲覧でき、
スピーカーフォローや記事のブックマークなど、便利な機能がご利用いただけます。
すでに会員の方はこちらからログイン
名刺アプリ「Eight」をご利用中の方は
こちらを読み込むだけで、すぐに記事が読めます!
スマホで読み込んで
ログインまたは登録作業をスキップ
関連タグ:
この記事をブックマークすると、同じログの新着記事をマイページでお知らせします