 PR
PR2026.01.19
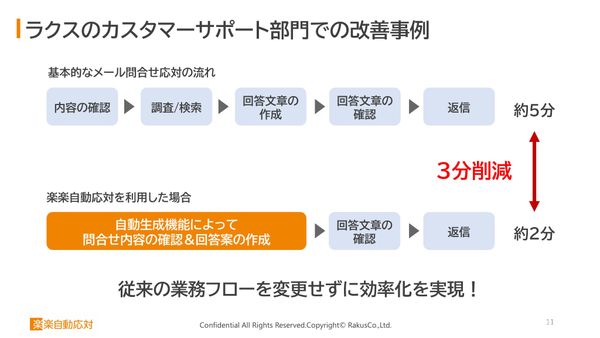
業務フローを変えずに、メール1通3分を削減 自動でAIにナレッジが貯まる問い合わせシステム「楽楽自動応対」
The 2017 Nobel Prizes: Biological Clocks and Microscopy(全1記事)
コピーリンクをコピー
ブックマーク記事をブックマーク
ステファン・チン氏: 科学ファンなら先日発表された今年のノーベル賞はすでに知っているでしょう。SciShowのチャンネルをいつも見てくださっているなら、ノーベル賞を受賞した重力波の研究はなじみのある分野かもしれません。

ですが生理化学の分野における研究も素晴らしいので、まずはそちらをご紹介しましょう。
今年のノーベル生理学・医学賞は体内時計の研究に関して、ジェフリー・ホール、マイケル・ロスバッシュ、マイケル・W・ヤングに贈られました。

人間も含めた生物は、地球の自転に合うような体内時計を持っています。例えば花は1日のうち決まった時間に開いたり閉じたりしますし、動物は夜明けや日暮れにより活発になります。

人間の場合も体の機能は、代謝からホルモンにいたるまで体内時計に基づいて1日の間に変動します。
長い間こうしたしくみがどのように起こっているのかはわかっていませんでした。
しかし1980年代から1990年代にかけて、彼らはミバエの体内の隔離された遺伝子からそのしくみを解明しようとします。それまでの研究では、ミバエの「ピリオド」という遺伝子が変異を起こすと1日の行動サイクルがおかしくなることがわかっていました。
ホール、ロスバッシュ、ヤングはこの遺伝子のDNA配列を隔離して解明しようとします。遺伝子から生成されるタンパク質は「PER」と名付けられました。
ホールとロスバッシュは、PERがそれぞれの細胞の中で毎晩生成され、日中に破壊されることを突きとめます。後にこのPERサイクルを促す、別の2つの遺伝子をミバエに見つけます。
ヤングは「タイムレス」という遺伝子を発見します。この遺伝子は、PERと結合して全DNAが格納されている細胞核に侵入できるようにするタンパク質を生成する遺伝子です。2つのタンパク質がピリオド遺伝子に影響を与えることで、PERの生成を抑制するのです。
これらは一連のしくみの結果、そのしくみ自体が抑えられる「ネガティブ・フィードバック」と呼ばれます。
ヤングはさらに「ダブルタイム」と呼ばれる、PERの生成を抑制するタンパク質を生成する3つ目の遺伝子も見つけました。PERの生成と破壊の切り替えをコントロールすることで、ダブルタイム遺伝子はフィードバックのタイミングを地球の24時間のサイクルに合わせているのです。
こうした「時計タンパク質」が全細胞にある他の遺伝子の活動も調節することで、臓器もそれぞれ1日の間に異なった活動をするのです。
今のところこの研究はミバエの遺伝子を解明しただけかもしれませんが、人間も含めた他の生物においてもわずかに異なるだけで同じしくみが備わっています。
こうした発見は、私たちの健康を司っていて、まだ理解が進んでいない「既日リズム」の分野の研究に拍車がかかるでしょう。
一方ノーベル委員会は今年のノーベル化学賞を、ジャック・ドゥボシェ、ヨアヒム・フランク、リチャード・ヘンダーソンに贈りました。

70年代、80年代、90年代に、彼らは「クライオ電子顕微鏡法」と呼ばれる、有機化合物を冷凍させることで間近に観察する技術を開発してきました。この技術によって体内で行われている極小なプロセスの解明につながったのです。
技術的に電子顕微鏡は、光学顕微鏡では見ることのできない細胞やタンパク質の小さな構造を観察できます。ですが、1930年代には、結晶化させた細胞や死んだ細胞でしか構造を観察することができませんでした。

2種類の電子顕微鏡がありましたが、どちらのタイプも強力な電子ビームをサンプルに照射することで観察していました。ですが、このビームは有機物を破壊してしまうため、タンパク質やウイルスを本来の姿で観察できません。
さらに電子ビームは気体分子があると揺らいでしまうため、顕微鏡は真空状態で使用する必要もありました。しかし、真空状態では有機化合物中の液体は水蒸気となって蒸発するため、細胞がだめになってしまいます。
受賞した3人の研究者たちは、驚くべき技術を使って体内における「分子マシン」を調べられるようにしました。
まずヘンダーソンは弱い電子ビームを使って、低解像度になる代わりに細胞サンプルを傷つけない方法を見つけます。それだけではなく、タンパク質サンプルをグルコース溶液に浸すことで、真空状態でも死滅しないようにしました。
これだけではぼんやりした画像しか得られませんが、フランクはぼんやりした2D画像を違う角度から何枚も撮影することで、くっきりした3Dモデルを作り上げる手法を開発します。
フランクはさらに顕微鏡画像を精細にする手法でも貢献しました。
最後に、ドゥボシェが液体に浸した異なるサンプルを凍らせることで、酸素がない真空状態でもサンプルを保護する手法を発見してブレイクスルーが生まれました。
塊の氷は顕微鏡の電子ビームを散乱させてしまうためうまくいきません。ですが氷はなにも、ふだん目にするレモネードに入れるような水の塊だけではないのです。
摂氏マイナス196度の液体窒素で冷やしたエタンを使って、ドゥボシェは液体に浸したサンプル液を急速に凍らせることで、ガラス化と呼ばれるなめらかなガラスのような形状にしました。この形状になった固体は液体の時と同じように電子がまっすぐ通り抜けられるにもかかわらず、真空状態の時と同じように静止状態にして扱いやすい状態にできるのです。
今ではこうした技術によって研究者たちは、細胞膜のレセプターが反応しやすい温度を調べ、細菌に抗生物質への耐性を持たせるタンパク質を特定し、ウイルスの構造を覗き見てより的確に効く薬を開発しています。他にもたくさんの応用がなされています。
SciShowも今年のノーベル受賞者を讃えたいと思います。みなさんの功績によって、宇宙の不思議、極大から極小の世界を見られるようになりました。おめでとうございます。
 Hank Green(ハンク・グリーン)たちがサイエンスに関する話題をわかりやすく解説するYouTubeチャンネル。 ・公式チャンネル
Hank Green(ハンク・グリーン)たちがサイエンスに関する話題をわかりやすく解説するYouTubeチャンネル。 ・公式チャンネル続きを読むには会員登録
(無料)が必要です。
会員登録していただくと、すべての記事が制限なく閲覧でき、
スピーカーフォローや記事のブックマークなど、便利な機能がご利用いただけます。
すでに会員の方はこちらからログイン
名刺アプリ「Eight」をご利用中の方は
こちらを読み込むだけで、すぐに記事が読めます!
スマホで読み込んで
ログインまたは登録作業をスキップ
関連タグ:
この記事をブックマークすると、同じログの新着記事をマイページでお知らせします