 PR
PR2026.02.26
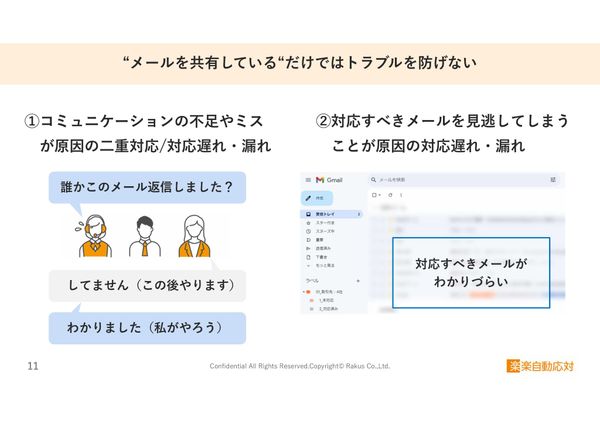
顧客対応で見落とし・重複が慢性化する理由 コールセンターに必須の“対応状況の共有”ができる「楽楽自動応対」とは
新たな認知症療法の開発(全1記事)
提供:京都リサーチパーク株式会社
コピーリンクをコピー
ブックマーク記事をブックマーク
2020年10月、ヘルスケア分野の新たなイノベーションと出会える、日本随一の英語ピッチ&パートナリングイベント「HVC KYOTO 2020」が開催されました。グローバル展開を目指す国内外の研究者やベンチャー企業から20名以上が登壇し、ヘルスケア部門の新技術についてピッチと講演を行いました。本記事では、スタンフォード大学 脳神経外科・神経内科 教授のMehrdad Shamloo氏による招待講演「新たな認知症療法の開発」をお届けします。Shamloo教授が、いまだに完全に治す方法はないとされている認知症について、研究の成果を紹介しました。
> ※本稿はスタートアップの起業ストーリーの一環として、HVC KYOTOでの基調講演を元に書き起こしています。学術的な表現、数値などについてはShamloo教授が執筆された原著論文および関連書籍でのご確認をお願いします。
*"Modulation of neuroinflammation and pathology in the 5XFAD mouse model of Alzheimer’s Disease using a biased and selective beta-1 adrenergic receptor partial agonist"
Pooneh Memar Ardestani, Andrew K. Evans, Bitna Yi, Tiffany Nguyen, Laurence Coutellier, Mehrdad Shamloo Neuropharmacology. 2017 Apr; 116: 371–386.
⼩栁智義⽒(以下、小桝):当セッションでは、Mehrdad Shamloo氏をお招きして、彼がサイエンスとビジネスをどのように結びつけたのかをご紹介いただきます。
Shamloo先生には、国境をまたいで長く製薬業界で働いてきた経験があるんですね。ヨーロッパでキャリアをはじめ、合衆国のベイエリアに移住して研究の事業化を進めました。現職のスタンフォード大学教授でもいらっしゃいます。
そして、ご存じの通り、「HVC KYOTO」では、毎回スタンフォード大学のトランスレーショナル・リサーチ(橋渡し研究)のトレーニングプログラム「SPARK」からゲストをお招きしています。午前のセッションでは、BioLabsのCEOであるJohannes Fruehauf氏をボストンからお招きし、ボストンのバイオテックエコシステムで何が行われているのかを、お話しいただきました。
このセッションは、ベイエリアでのエコシステムサイエンスについて知るため、SPARKからMehrdad Shamloo博士をお呼びしています。それでは、どうぞお話しください。
(拍手)
Mehrdad Shamloo氏(以下、Mehrdad):わかりました。ありがとうございます。Mehrdad Shamlooです。こうしてお話しする機会をいただき、ありがとうございます。本当なら日本の美しい京都に行きたかったのですが、残念なことにCOVID-19の影響で行けませんでした。
経歴を少し付け加えますと、私は今スタンフォード大学で教授をしております。今日もスタンフォードからです。かつては、スウェーデンにあるルンド大学のワレンベルグ神経科学センターというところで研究をしていました。
神経科学分野の橋渡し研究に関心があって、サンフランシスコ湾のベイエリアに移住し、3つの異なるバイオテクノロジー企業で科学者のアソシエイト・ディレクター・プログラムのディレクターを務める立場になりました。そして、神経科学分野の橋渡し研究のさまざまなステージに関わることができました。IPOを経験し、2007年には学術的なルーツに戻り、スタンフォードで学術的な地位に就き、研究を続けてきました。スタンフォード大学での研究の事業化や創薬(新たな医薬品が製品となるまでの一連の過程)が恋しくなったというのが、SPARK(創薬・診断法開発推進プログラム)に協力している理由です。
Mehrdad:私自身、初のバイオテックのスタートアップを始めましたので、今日はこの2年前に設立したスタンフォード・キュラセン・セラピューティクスの話をしましょう。私は神経薬理学者なので、認知症の話ですね。
認知症は原因不明の途方もない病気で、複数の形態があります。「アルツハイマー病」はもっとも一般的なものです。天才芸術家・画家のWilliam Utermohlen氏のこの自画像は、彼の生涯で何があったのかを教えてくれます。
1967年から1996年、最初の30年間はとても素晴らしい絵です。そして、最後の3年間は急速かつ段階的に劣化し、もはや顔全体を描くことができませんでした。
これは複数の病気や原因によって生じる症状で、私たちもなぜこのようなことが起こるのか本当にわかりません。ただ、多くの人に共通して、日常生活の中で認知機能を失うことがわかっています。覚えることができないんですね。生活の中で慣れ親しんだ項目(だけ)を認識することができます。
亡くなった後に脳を検査してみると、脳内の組織に大規模な神経細胞の損傷が見られます。アミロイドプラークや神経原線維のもつれの蓄積、大規模な炎症などのアルツハイマー病や認知症の病理学的マーカーが見られます。
しかし、認知機能の低下は、病気における真の主な症状であり、これらの病理学的な原因のすべてが認知機能障害につながっています。認知症はアメリカでは、死因の6番目となっていて、治療法はありません。これを理解するために、私は研究人生を捧げてきました。
大学院生の時、私は脳の小さな核にとても興味を持っていました。「青斑核」と呼ばれる神経核で、前脳基底部にあります。ここは脳内のノルアドレナリンの伝達と生産の主な源です。この青斑核からのニューロンは脳全体に広がっていて、 見慣れた顔を認識したり、覚醒レベルを制御したり、新しいことに注意を払うことに関与しています。これらのニューロンが認知症患者の脳で劣化しており、私は人生の中で非常に長い間注目してきました。
この全体的で深刻な神経細胞の損失と劣化に関する50〜60年代の素晴らしい論文は、最終的には病理学の教科書に記載されています。アルツハイマー病で亡くなった方の脳組織を観察すると、パーキンソン病と同様に、この特定の核のすべてのニューロンが衰退し、失われていることがわかります。このことは、パーキンソン病とレビー小体型認知症と比較対象となるコントロール(正常な人間)の死後脳の細胞数の定量データでも明らかで、同等あるいはより深刻な損傷がパーキンソン病で検出され、報告されています。

次のPET画像は脳のMRI画像で、ヒトの前脳にあるアドレナリン神経細胞の受容体を示しています。

この画像は、対象者の脳全体の受容体密度を示しています。神経認知障害がわかっている方のものです。私が着目したのは、アドレナリン作動性ニューロンがダメージを受けていても、受容体は無傷だということです。したがって薬理学的な介入で接続性を回復できます。
つまり、この神経は死につつありますが、シナプス受容体の下流にある後シナプス細胞の受容体は無傷なのです。そこで思いついたのが、低分子を使ってこれらの受容体を調節することで、認知症患者の認知機能あるいは認知機能のある領域を回復させることができるのではないかということです。

これは、その状態を示すポンチ絵です。アルツハイマー病やパーキンソン病、レビー小体型認知症で変性しつつあるシナプス前細胞、青斑核のノルアドレナリンニューロンです。これらはシナプス後細胞の受容体であり、シナプス前細胞から神経アドレナリン伝達とノルアドレナリン・ノルエピネフリンを受け取るべき細胞です。これは神経伝達物質を受けとる受容体です。
私は低分子のモジュレーターアクチベーターを使って、この受容体を安全に活性化し、脳内の炎症付近の炎症を正常化することができるのではないかと考えました。なぜなら、ノルエピネフリン(別名ノルアドレナリン:交感神経の情報伝達に関与する神経伝達物質)は、疾患の病態における炎症の調節に非常に重要な役割を果たしているからです。この話の最初のバックグラウンドで説明した3つの領域です。
そこで私は非常にシンプルな問いを考えました。もし私の仮説が正しいのであれば、「血圧を下げるためによく使われているβ遮断薬(交感神経のアドレナリン受容体のうち、β受容体のみを遮断する薬剤)を使うと、認知機能が低下する」のではないか?」
その場合、血液脳関門を通過するβ遮断薬は、動物モデルで認知機能に障害を与える可能性があるということになります。
そこで、正常なマウスに文脈記憶訓練を行いました。これは「フィールドメモリー」と呼ばれる、感情のパビリオン型の学習と記憶です。マウスに音と共に罰や、軽いショックを与えると、聴覚刺激がショックを伴うという「文脈」が記憶されます。
文脈を記憶させた3日後、一般的に使われている血圧の薬である「メタキサロン」「アテノロール」を投与しました。これらはすべて、現在クリニックで使われている降圧剤であるβ遮断薬です。
マウスは文脈を記憶した環境に戻ってきた時、その環境が非常に不快な環境であったことを覚えていなければなりません。しかし、文脈検索、記憶検索のタスクの前にこのマウスにβ遮断薬を注射すると、記憶検索を2~3倍にブロックすることができました。記憶障害の程度は非常に深刻であり、その程度はβ遮断薬の脳への浸透度に依存しました。一般的なβ1、β2受容体ブロッカー(遮断薬)の中には、記憶の検索を著しく阻害するものがあります。
(動画再生)
今、動画を流していますが、マウスは物体と比較するとマウスと交流します。さらに、馴染みのあるマウス(ケージメイト)と新しいマウスを比較すると、新しいマウスと一緒に時間を過ごすことを好みます。
ここで見られるのは、2つの新しい対象に対する習慣化であり、マウスは物体よりもマウスとの交流を好むということ。そして、見慣れたケージメイトと新しいマウスであれば、新しいマウスを好むことがわかります。ヒトとはまったく違います。これが正常なマウスです。
アルツハイマー病のマウスでは、馴染みのあるマウスを思い出して認識する機能に障害があります。そのため、もしケージメイトと新しいマウスの選択肢を与えても、マウスは両方に等しく交流することになります。
β遮断薬を使った一連の実験では、β遮断薬に依存して、新しいマウスとケージメイトを見分けるという社会的記憶が損なわれることが示されました。つまり、β遮断薬は単純に機能としての記憶を損なうだけでなく、社会的記憶をも損なうということです。
私たちはこの実験を行い、感情学習と社会的記憶を司る扁桃体の脳内にβ遮断薬を注入する方法を数多く発表しました。さらにβ受容体の下流にあるPKA(プロテインキナーゼ)阻害剤を使用しても同様の結果が得られています。
ノックアウトマウス(1個以上の遺伝子が無効化された遺伝子組換えマウス)を用いた場合、β1、β2のノックアウトマウスいずれにおいても障害が見られます。特にβ1は、この社会的記憶課題においてマウスと比較して障害がありました。
マウスの炎症モデルにおいて、コンディショナルかつ選択的にβ1またはβ2受容体を遺伝的に除いた時、脳の炎症が亢進し、末梢でも炎症が増強されました。

要約すると、これまで降圧剤として 一般的に使用されているβ遮断薬は、もし血液脳関門を通過してしまうと神経炎症を引き起こし、記憶力や社会的記憶力を損なうということです。これは、エタノールのようにバリアを越えないβ遮断薬には当てはまりません。
しかし、すべてのβ遮断薬は一旦血液脳関門を通過してしまうと、全身あるいは中枢性炎症の増強を引き起こします。
さて次に考えた課題は、β遮断薬や遺伝子改変で導入した記憶障害を確立したけれども、アルツハイマー病のモデルで何が起こるのかということです。β作動薬を使用するとどうなるでしょうか。私たちはβ遮断薬が記憶を傷害することを示しましたが、認知機能を再強化するためにアルツハイマー病の疾患モデルでβ作動薬が使えるでしょうか?

マウスにおいてヒトAPP(アミロイド前駆体タンパク質)を過剰発現させるとアルツハイマー病を引き起こし、社会的記憶の障害を引き起こします。
左の図では、これに対してβ1受容体に対する部分的作動薬であるザモテロールを単回投与すると、トリプルスター機能とも言える社会的記憶の認知機能を回復することを示しました。
私にとってこれは、これらの回路のシナプス前結合はなくなっているものの、後シナプス受容体は無傷であり、1回の注射でその機能を獲得できれば、人を助けることができる可能性があると示すものでした。もちろんこれはマウスを使ったモデルであり、大規模なモデルで何度も繰り返し、何度も論文発表しなければなりません。
右の図ではアルツハイマー病疾患モデルでの記憶回復実験結果を示しています。ザモテロールの投与によって、用量依存的に文脈記憶が回復していることがわかります。

衝撃的なこととして、ほぼ3ヶ月間マウスを用いた慢性実験では、脳内全体のアミロイドβのレベルが大きく減少しており、特に海馬での減少が顕著に見られました。
これは抗アミロイド抗体β6E10で、緑色に染色しています。左側がコントロール(対照実験)ですが、左には見られる緑色のアミロイドβの病理像が減少しています。β140とβ142と言った凝集を引き起こすアミロイドβの断片についても、両方とも有意に減少していました。
しかし我々が予想していなかったこととしては、炎症の大幅な減少が観察されたということです。β作動薬の投与がアルツハイマー疾患モデルにおいて脳内の炎症が有意に減少していることがわかります。
野生型に比べてアルツハイマー疾患モデル(5XFAD)の扁桃体での炎症が有意に増大していますが、ザモテロールの投与によってそれが抑えられていることがわかります。同じ傾向がTNFα、CD74、IL1β、IL6などが顕著に減少していました。
しかし一方で、貪食(Phagocytosis)を促進するCD68のような炎症性マーカーの亢進も見られます。つまり、単に炎症を抑えるだけではなく、アドレナリンの調節が炎症を調節(Regulation)しているということです。
AT8抗体を用いたリン酸化タウの低下も見られましたが、これは数年前に発表したデータです。
この部分を簡単に要約すると、私が示したのは、β作動薬がマウスのアルツハイマー病疾患モデルにおいて
●認知機能を改善した
●アルツハイマー病の病理学的特徴を減少させた
●神経炎症を抑制した
ということです。

その時まで、SPARKの助けを借りて、すでに会社を始めることを考えていました。およそ2年前のことです。アドレナリン受容体は9種類あって、すべて異なるタイプの受容体です。
これは、薬理学的なアドレナリン系を表現したものです。後シナプス側にβ1とβ2、α1があって、前シナプス側にモノアミン酸化酵素(略称MAO:ドーパミンやセロトニンを分解する働きを持つ)も見えると思いますが、これは複数のレベルにおいて創薬標的となっています。β2は心血管疾患や数多くの他の疾患の薬剤開発の標的となっています。
MAOはうつ病のターゲットでしたが、α2も1と同様にターゲットになっています。しかし、重要なのは、アルツハイマー病や他の神経認知疾患では、このシナプス前の劣化がかなり早い段階で起こっているとは誰も考えていなかったということです。アドレナリン系を標的とするならば、シナプス後受容体に注目しなければなりません。

そこで、シナプス後β1およびβ2受容体に対する安全な作動薬(生体内の受容体分子に働いて神経伝達物質やホルモンなどと同様の機能を示す薬)の開発に着手しました。
これはGタンパク質共役型受容体(GPCR)多重シグナル伝達カスケード、βアレスチンとPKA/cAMP経路ですが、受容体を遺伝子工学的に改変することで作動薬や遮断薬をスクリーニングすることができます。私の業界での経験とスタンフォード大学でのSPARKプログラムのおかげで、作動薬の種類による異なる生物学的機能を持つこともわかったのです。
そして、このシステムを利用してすでに公知な2つの化合物を同定しました。しかし、最も重要なことは、私の研究室で3人の医薬化学者と共にこのターゲットのために新規化合物を作り始め、500以上の新しい化学物質を作成しました。
そして、私の研究室での2年間の努力の末に、薬理学と化学の叡智を結集して非常に強力で、非常に選択的な作動薬を同定することができました。

この時点で、スタンフォードでフルタイムの教授をしていて起業に成功している業界人を探しに行きました。Anthony Ford氏と Kathleen Glaub氏は、メルク製薬に会社を売却したばかりで、スタートアップ企業を探していたところでした。
これは素晴らしい選択でしたね。そのような努力をしている人には、ビジネスで以前にやったことがあるような成功者が必要ですし、このプロジェクトにフルタイムで取り組んでくれるリーダーシップレベルの人が必要です。
前列のRobert Booth氏はロシュ・パロアルトの研究主任で、私の親友で、この活動を手伝ってくれました。私たちはほぼ2年前に資金調達を始めました。分子を使った臨床試験を始めるために、5,500万ドルでシリーズをクロージングしました。それ以来、すべて既知の分子を使って報告できてうれしいです。
ヒトを対象とした複数の概念実証研究をキュラセンのNCE(新規化学物質)を用いて実施してきましたが、すでにヒトでも問題なく実施されていました。公開されたニュースによれば、患者は第1相の患者であり、第1相の臨床試験も現在進行中だそうです。
本当にワクワクしています。少なくともこの努力によって、研究室で観察したことを検証し、それを安全な方法でヒトの臨床試験にトランスレーション(橋渡し)することができるんです。私も神経科学分野の橋渡し研究者として、そのトレーニングをしています。
もちろん、科学や生物学を理解することが第一目標ですが、それによってどうやって人間の障害を治すかということも第二の目標であり、(ある意味で)第一の目標です。スタンフォードのSPARK、そしてSPARKのアドバイザーのみなさんがいなければ、このようなことはできなかったでしょう。
今、私の研究室では、脳内の特定の核のニューロンがなぜ細胞死しやすいのかを理解しようとしています。なぜニューロンが死滅しているのか? その理由はライフスタイルの種類です。最近はストレスが多すぎて活性化しすぎてしまいます。コンピューターの使いすぎです。仕事のストレスや通勤時間が長すぎます。どれも生物学的には問題ないことですが、なぜこれらのニューロンが死滅するのか。それを防ぐ方法はないのか。それを動物モデルで理解しようとしています。
この考えに独自性があることには間違いないです。研究室では今まさに、海馬青斑核における特定の神経脆弱性、ツール開発、神経細胞の変性を防ぐための生物学への理解を目指しています。
私のチームに感謝します。もう私とチームで一緒にいるわけではありませんが、MCプログラムの化学者であるMichael green氏とAlam Jahangir氏は、2人ともまだコンサルタントの研究室にいてくれています。他にも2つほど薬理化学のプロジェクトを手伝ってくれています。

Bitna氏はギリアドにいます。Andy氏は、自分の研究室に移ったシニアの科学者です。Laurence氏は5年前にラボを去った科学者です。Pooneh氏も診療所にいます。そして私の研究室の2人のシニアスタッフは、まだ私とIn Vivoファーマコロジーを行っています。
ご拝聴いただきありがとうございました。ご質問があれば答えていきたいと思います。ありがとうございます、Daria氏とKevin氏。スタンフォードのSPARKのリーダーたちもありがとうございます。彼らのリーダーシップとアドバイスがなければ、これは実現しなかったでしょう。私は会社を始めようなんて思わなかったでしょうから。
私は産業界から戻ってきたのですが、もう引退しています。最後の会社(アフィマックス)ではIPOをしました。アフィマックスがタケダ(武田薬品工業)に買収された後、すぐに退社しました。そのため、このようなことをする予定はなかったのですが、結果的にはうまくいきましたし、とても刺激的です。これもDariaとKevinのおかげです。ありがとうございました。
(拍手)
⼩栁:Mehrdadさん、ありがとうございました。新しいスタートアップを含めたバイオ業界でのキャリアも含め、素晴らしい科学的な講演をしていただけて大変光栄に思います。
続きを読むには会員登録
(無料)が必要です。
会員登録していただくと、すべての記事が制限なく閲覧でき、
スピーカーフォローや記事のブックマークなど、便利な機能がご利用いただけます。
すでに会員の方はこちらからログイン
名刺アプリ「Eight」をご利用中の方は
こちらを読み込むだけで、すぐに記事が読めます!
スマホで読み込んで
ログインまたは登録作業をスキップ
京都リサーチパーク株式会社
この記事をブックマークすると、同じログの新着記事をマイページでお知らせします