 PR
PR2026.02.26
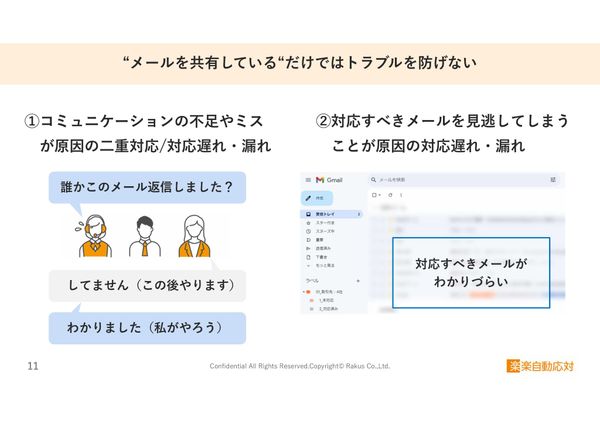
顧客対応で見落とし・重複が慢性化する理由 コールセンターに必須の“対応状況の共有”ができる「楽楽自動応対」とは
Are We Ready to Edit the Fetal Genome?(全1記事)
コピーリンクをコピー
ブックマーク記事をブックマーク
ハンク・グリーン氏:もしかしたら、遺伝子治療は、医学界において過去数年の中でもっとも驚くべき発展を遂げた分野のひとつかもしれません。我々が人間の遺伝子的構造を変えることにより、特定の病気の治療ができるようになるなど、まるでSFの中の話のようです。
実際、私が子どもの頃はそうでした。しかし、遺伝子治療は誤解されている部分があります。遺伝子治療の中でもっとも誤解されている部分は、この技術を用いて、子どもが生まれる前にその子の特徴を選ぶことのできる、いわゆる「デザイナーベイビー」を作れるようになる日が来るのではないかという点です。
そのようにして、子どもの知能や目の色、挙げ句の果てには、その子どもが将来ハゲるかどうかさえも決められるというのです。しかし実際のところ、現在ほとんどの遺伝子治療の研究において、胎児細胞を修正するなどということはまったく行われていません。
そして、もしそうだったとしても、研究者たちが目指しているのは、遺伝性疾患を予防したり治療したりするといったことであり、可能だからといってDNAをカスタマイズするなどということはしません。
遺伝子治療は、ある意味、他の医学療法と同じと言えるでしょう。しかし、同時にまったく異なる部分もあります。いずれにせよ、胎児細胞に手を加えるということは、医学界の将来においてかなり大きな部分を占めることであると言えるでしょう。しかも、そう遠い将来ではないかもしれません。
遺伝子治療はいくつかの異なるタイプがありますが、一番研究されている分野はウイルスが関係するものです。基本的には、科学者が「媒介体」と呼ばれるウイルスを取り、病気の原因となる部分を取り除くというやり方です。
それから、その「媒介体」が運ぶ情報をその中に入れるのです。その情報は通常「指示」の形をとり、欠けているタンパク質などを生産するよう体に指示を出すのです。例えば、「血友病」の患者は、血液を固める特定のタンパク質を十分に持っていません。そこで、それを治療する遺伝子が細胞にその種のタンパク質分子を作るように指示を与えます。
過去数年間、人間と実験動物を対象にしたテストで、遺伝子治療の成功が増えてきています。しかし、人が生まれた後に病気の治療をすると合併症が生じることがあります。治療にリスクが生じることもあり、治療法が十分でないことも、治療そのものに効果がないこともあるのです。
そこで登場する「胎児の遺伝子治療」は、その子どもが生まれる前に病気の原因を予防するという方法です。その方法には胎児を直接治療したり、羊水などに「媒介体」を注入することにより胎児を治療するといったものが含まれます。
その方法がどうであれ、ほとんどの研究者はそのような治療法がどんな場合にも用いられるべきではないと考えています。1990年代後半、イギリスの「遺伝子治療諮問委員会」はいかなる胎児の治療においても考慮されるべき2つの基準を発表しました。
まず、その治療が、移植や出生後の治療など、他のいかなる治療と比べて明らかに利点があるべきであること。そして2つ目に、他にふさわしい治療法がなく、生命に関わる病気に対してのみ用いられること。つまり、他の医療と同様、その患者ができる限り健康になれるよう助けるために用いられるべきで、遺伝的に改造することにより「X-Man」を作ったりしてはならないというのです。他の倫理委員会もそれと同様の基準に同意しています。
しかし、それらのガイドラインを持ってしても、ほとんどの治療法は現段階で人間の胎児で試すにはリスクが高すぎるので、ほとんどの研究対象は動物に留められています。妊娠中の人は血液や組織をテストすることにより、生まれて来る子どもに遺伝子疾患があるかどうかを見極めることができます。
例えばその遺伝子疾患には、嚢胞性線維症、血友病、鎌状赤血球貧血症などがあります。しかし、テストで陽性反応が出たとしても、すぐに対処できる方法はあまりありません。それでも進歩は見られています。
2018年に発表された、『Nature Medicine』誌の確証ある研究で、人間でいうところの「ゴーシェ病」に似た病気を持つネズミの治療において、胎児の遺伝子治療がいかに有効であるかが示されました。「ゴーシェ病」とは、遺伝的疾患で、酵素欠損を引き起こします。特に、「グルコセレブロシダーゼ」という酵素が欠陥します。それが欠損すると、体内の老廃物が蓄積されてしまい、さまざまな病気の原因となります。
よく行われる治療法として、毎週酵素を注入する方法がありますが、「タイプ2」の「ゴーシェ病」の場合、その治療法はありません。「タイプ2」の場合、脳に十分な量の「グルコセレブロシダーゼ」がありません。それに、「血液脳関門」がほとんどの分子を締め出してしまうため、酵素を注入しても効力がなくなってしまいます。
この疾患は死に至ることが多く、この疾患を患う胎児は、生まれた時にはすでにかなりのダメージを受けてしまっています。
そこで、研究者たちは「胎児の遺伝子治療」を用いてこの疾患の治療ができないか、研究を行ってきました。2018年に行われた実験で、科学者たちはネズミの胎児の脳に、欠損する酵素を作り出す指示を持った「媒介体」を注入しました。すると、効果があったのです!
低体重の傾向が見られ、運動テストにおいて良い結果が出ませんでしたが、そのネズミには比較的普通の酵素活動が見られました。
その後に行われた追加の実験でも良い結果が見られました。その実験では、研究者たちが脳ではなく血管にその「媒介体」を注入しました。実験対象となったネズミは、倫理的理由により実験後55日間しか生存させられませんでしたが、その間、ネズミは他の普通のネズミと何も変わったところが見られませんでした。その研究チームは「媒介体注入法」が、「マカク」といった、さらに大きな動物においても有効であることも証明しました。
その実験が大成功したので、科学者の中には人間での臨床試験の準備ができている、と主張する人もいました。しかし他の人たちは、前臨床試験の成功が必ずしも臨床試験の成功につながるわけではないと反対しました。彼らはさらなる実験が必要であると考えたのです。
結局「胎児の遺伝子治療」は、科学的にも倫理的にも本当に複雑なのです。もし人間の胎芽に対して、または大きくなって普通の子どもになるはずの胎児に対して臨床試験を始めるなら、いずれにせよ、一人の人間の人生に関わっていくことになるからです。それを軽く考えるべきではありません。
今まで胎児に臨床試験が行われたことはありましたが、その時の方法は安全のためにしっかりと研究され、安全であると証明されたものでした。2018年の他の研究が『The New England』誌に掲載されました。その研究では「XLHED」という、汗腺が欠損する遺伝性の疾患を予防するために「胎児の遺伝子治療」が、3人の胎児に対して行われました。
その論文が発表された時点で、子どもたちはすでに1歳半ほどに成長していましたが、彼らに健康上の問題は見られませんでした。鍵となるのは、研究者たちが、広範囲にわたってテストされた方法を用いたことと、自分たちの病院の倫理委員会から承認を得ていたという点です。
この状況は、その数ヶ月後にニュースになったものとはまるで異なっていました。それは、中国の研究者たちが新しいゲノム編集の技術である「CRISPR」を用いて人間の胎芽の一部に変更を加えたというものでした。
この試験は、ほとんどの倫理ガイドラインに違反するものでした。まず、この実験によってなされたことは、赤ちゃんがエイズに感染する確率を減らすというもので、それなら他にももっと安全な方法があったのです。また、科学者たちは委員会の認証を得ておらず、何より、彼らの用いた方法は安全であるという確証がなされていませんでした。
「CRISPR」は、研究所の中では大きな成功を収めていましたが、それと同時に、稀に変異が見られるということもわかっていたのです。幸いなことに、被験者となった子どもたちは今のところ健康ですが、ずっと健康であるという確証はありません。ですから、ガイドラインが存在するのには理由があるのです。
将来、我々が胎芽のゲノムをさまざまな方法で編集できるようになると思われますが、もしそのような日がやってきたとしても、他にも考慮すべきことが生じるはずです。例えば、もし誰かの編集された遺伝子が子孫に遺伝したらどうなるか、編集された遺伝子がその人の一生の間に変異したら、といたことについて考慮すべきです。
さらに重要な疑問として、遺伝子編集はどの段階までなら許されるのか、もしこの科学の進歩が進化の過程に影響を与えるとしたら、それは問題になるのか、といったことも考えられます。現段階で言えることは、「胎児の遺伝子治療」は必要不可欠な治療にのみ行われるべき、ということです。
次の段階で行われるべきなのは、科学者たちがすでに始めている動物実験を続けることにより、この科学がどのように有効になるのか、リスクは何なのかをよりよく理解することです。なぜなら結局、これらの実験がもっと人間の臨床試験に用いられるようになった時、しっかりと安全が保障されていなければならないからです。
続きを読むには会員登録
(無料)が必要です。
会員登録していただくと、すべての記事が制限なく閲覧でき、
スピーカーフォローや記事のブックマークなど、便利な機能がご利用いただけます。
すでに会員の方はこちらからログイン
名刺アプリ「Eight」をご利用中の方は
こちらを読み込むだけで、すぐに記事が読めます!
スマホで読み込んで
ログインまたは登録作業をスキップ
関連タグ:
この記事をブックマークすると、同じログの新着記事をマイページでお知らせします