 PR
PR2024.12.10
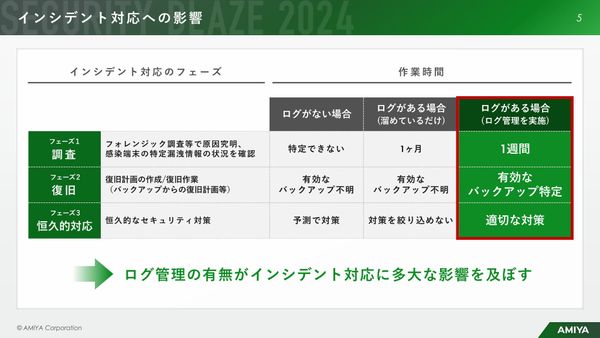
“放置系”なのにサイバー攻撃を監視・検知、「統合ログ管理ツール」とは 最先端のログ管理体制を実現する方法
How to Make a Lemon Battery(全1記事)
リンクをコピー
記事をブックマーク
ハンク・グリーン氏:『SciShow』の実験動画にようこそ。今回の実験では、科学実験史上で最もオーソドックスではありますが、最も誤解が多い実験を行います。
実験において重要な点は、電気はレモンのなかに存在しないことです。まずこれを行います。

まず、レモンを数回転がします。レモンのなかのジュースの小さな塊を壊し、全体にジュースが行き渡るようにします。

そして、レモンの片側に亜鉛メッキを施した釘を差し込みます。もう片方には銅素材を差し込みます。今回は銅線を使います。

きっと驚くと思いますが、電圧計を銅線と釘につなげるだけで電流が発生しているのが見えます。

もし、「なぜ金属間で電流が流れるのか」と聞かれたら? きっと困惑するか、間違った答えをするかのどちらかでしょう。では、正しい答えを教えましょう。
バッテリーと呼ばれる電気化学セルは、3つの要素を必要とします。2つの電極と、電解質です。片側の電極がもう一方より強力に電子を必要としている状態を、化学的に「高い電気陰性度を持つ」と呼びます。
電子をより必要としているその電極は陰極と呼ばれ、電子を与える側は陽極と呼ばれます。
レモンバッテリーではワイヤーの銅と、釘の亜鉛を使います。銅は亜鉛より電子を強く必要としている負電荷なので、陰極として働きます。

では、単に銅と亜鉛をつなげて電子の移動を眺めることはできないのでしょうか? レモンの働きって何? せっかく買ったのに使えないなんて!
電子は勝手に素敵で安定した自分たちのホームを放棄したり、陽極から陰極に移動したりすることはありません。それを防ぐ巨大な力が働いているのです。
亜鉛は電子を失うとともに、陽子も失わなければなりません。そこで第3の要素が必要となります。それが電解質です。
銅と亜鉛をワイヤーでつなげば、電子は自由に移動できます。しかし陽子は電子より巨大すぎて、ワイヤーを通じて移動できません。そんな事は起こり得ないのです。でも、イオン溶液があれば移動が可能になります。
例えば、希釈クエン酸などがイオン溶液になります。それが私たちの電解質です。
亜鉛がレモンジュースの酸に触れた時、酸性化し電子が亜鉛から離れ、正電荷の亜鉛イオンが溶液に流れます。そして電子は金属内に集合し、ワイヤーを通じ銅のほうへ一気に流れ出します。銅は亜鉛より電子を必要としているためです。
銅へ移動した電子は、酸から数個の陽子や水素イオン引き連れて減らし、電子を追加します。結果水素ガスが発生し、もし現場で観察すれば、銅の電極から小さな泡として上がってくるのを確認できます。
まとめとして、電気はレモンから発生するのではなく、亜鉛と銅の電荷の違いから起きる化学反応により生じるということです。電子は銅側に移動したがっており、レモンジュースが電子の脱出の扉を開くのです。
証拠が欲しい? より強力な電気を起こすために、複数のレモンを連続してつなげたレモンバッテリーの実験を幾度か見たことがあるかもしれません。でもそんなことをする必要はないのです。
同じレモンに3本の銅線と釘をそれぞれ差し込めば、約3倍の電流を得ることができます。レモンに十分なスペースとジュースがある限り、パワーはレモンのなかではなく、亜鉛に存在しているのです。
 Hank Green(ハンク・グリーン)たちがサイエンスに関する話題をわかりやすく解説するYouTubeチャンネル。 ・公式チャンネル
Hank Green(ハンク・グリーン)たちがサイエンスに関する話題をわかりやすく解説するYouTubeチャンネル。 ・公式チャンネル関連タグ:

2024.12.10
メールのラリー回数でわかる「評価されない人」の特徴 職場での評価を下げる行動5選

2024.12.09
国内の有名ホテルでは、マグロ丼がなんと1杯「24,000円」 「良いものをより安く」を追いすぎた日本にとって値上げが重要な理由

2024.11.29
「明日までにお願いできますか?」ちょっとカチンとくる一言 頭がいい人に見える上品な言い方に変えるコツ

2024.12.09
10点満点中7点の部下に言うべきこと 部下を育成できない上司の特徴トップ5

2024.12.04
いつも遅刻や自慢話…自分勝手な人にイラっとした時の切り返し 不平等な関係を打開する「相手の期待」を裏切る技

2023.03.21
民間宇宙開発で高まる「飛行機とロケットの衝突」の危機...どうやって回避する?

2024.12.03
職場の同僚にイライラ…ストレスを最小限に抑える方法 臨床心理士が語る、「いい人でいなきゃ」と自分を追い込むタイプへの処方箋

2024.12.06
嫌いな相手の行動が気になって仕方ない… 臨床心理士が教える、人間関係のストレスを軽くする知恵

2024.12.05
「今日こそやろう」と決めたのに…自己嫌悪でイライラする日々を変えるには

PR | 2024.12.04
攻撃者はVPNを狙っている ゼロトラストならランサムウェア攻撃を防げる理由と仕組み