ゲノム解析が現在(いま)できること
三嶋博之氏(以下、三嶋):よろしくお願いします。長崎大学人類遺伝学の三嶋と申します。タイトルが「ゲノム解析が現在(いま)できること」ということなんですが、まず自己紹介です。
私のバックグラウンドですけれども歯科医師でして、卒業してから口腔外科に残りまして、ひょんなことから口唇口蓋裂の診療チームに参加させていただきました。
口唇口蓋裂というのは先天的な口と唇、あごの病気なんですが、外から見える形の先天の病気としては、最も頻度の高いものの1つです。
日本であれば、適切な時期に適切な治療をチームで行っていくことで、大人になるまでにはずいぶんきれいに治すことができる病気です。
それで短い期間ではあるんですけれども、日本口唇口蓋裂協会のベトナムでの医療援助に、参加させてもらうことがありまして、写真は2002年……ずいぶん古い話なんですが。そのときに痛感したのが、日本でやるような治療をアジア全域でしっかりやっていく、これは容易ならざることだなということです。
今、アジアって言ったんですけれども、口唇口蓋裂の病気、普通は親から子に遺伝するものではありません。多くの場合は、そういうパッと見た形で遺伝するものではない。
しかしアジア人集団、ヨーロッパ人集団、アフリカ人集団、そういう集団で見ていくと、明らかにアジア人に頻度が高い病気ですから、そこには何か遺伝的なバックグラウンドがあるんだろうということは言われております。
となれば、遺伝医学を勉強すれば口唇口蓋裂を予防できるんじゃないかと夢を持ちまして、遺伝医学の門をたたいたということになります。
このあと示しますけれども、そのあとゲノムの解析の技術は急速な発展がありました。その結果、大量なデータが出てくると。そこでたくさんのデータがありますから、それを解析したいのは自分なので、「じゃあ、自分で解析をやりましょう」ということで1から7まで、ずいぶん変わってしまったんですけど、今コンピューターメインでやっております。
ポストヒトゲノムプロジェクトの進化
ヒトのゲノムという言葉がよく出てくるんですけど、意味は全部の遺伝情報という意味です。これは人間の一つひとつの細胞の中の核の中に、化学物質であるDNAを使って記録されている。DNAは4種類、A、T、G、Cという4つの文字があって、それが文字に例えると30億文字でひとりのゲノムというのができているわけです。
1990〜2003年の間、ポストヒトゲノムプロジェクトというのが行われました。2001年の時点では、ひとりのゲノムを読むために95億円のお金がかかりました。そして13年の年月、そしてたくさんの研究者の努力があったわけです。
これが大きなブレークスルーになって、ポストヒトゲノムプロジェクトとして、今年、もっと安いかもしれないんですけれども、ひとり読むのに20万円と3日をかければできる。全くケタが違うわけです。
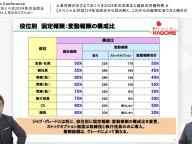
ゲノムの多様性を扱う次世代シークエンサー
それがなぜ可能になったかというのは、2005年からの次世代シークエンサーの登場が大きなものです。
これは各社の機械があるんですけれども、さっきロボティクスの話がありました。中身はロボットです。たくさんの液を交換しながら、温度を上げたり下げたりというのを自動的にやる機械であります。
そして、この機械の登場で何がわかるようになったか。ひとりのゲノムを読むのが、たくさんの人のゲノムを読むことができるようになった。そこでわかったのは、一人ひとりが似てるんだけど、ちょっとずつ違う、ヒトのゲノムの多様性です。ヒトのゲノムの多様性を扱うことができる時代になったわけです。
ひとりの人、30億という数字的には大きいんですけど、思うにひとりのゲノムというのは、たいしたデータではありません。しかし、これがたくさんの集団、日本におけるもの、アジアにおけるもの、そしてあとで話しますけど、ひとりの体の中で、がんの中とかでは、また多様性がある。そういう多様性を扱うときに、初めてビッグデータというものになるのかなと思っております。
病気の遺伝要因と環境要因
ゲノムを読めば全てがわかるかというと、決してそういうことではありません。ゲノムのA、T、G、Cを読めたからといって、それが何を意味してるか、決して全部わかるわけではなくて、ごく一部しかわからない。
さらにゲノムだけじゃなくて全ての病気というのは、多かれ少なかれ遺伝の要因と環境の要因の2つが絡んでいるわけです。
例えば、事故とか感染症というのは、ほとんど環境要因になります。そして自分が専門としている単一のひとつの遺伝子で起こるような病気は、遺伝の要因が大きくなっています。
そして、その中間に来るような生活習慣病、多因子疾患、高血圧、糖尿病といったような病気は、環境要因、遺伝要因の両方があるということになります。先ほどの口唇口蓋裂は、この中間点ぐらいにくる病気になりますね。
そうやってゲノムのことを勉強してきますと、さっき伊藤穣一さんの話で統計の話から逃げられないというような趣旨の話があったと思いますけれども、ゲノムを読んで3つ(の理解の領域が)あります。
単一遺伝子病とかになるんですけど、完全にわかってしまうこと。そして全くわからないこと。その間に大きく確率でしかわからない、確率でわかるという領域があります。
ここでは確率という話が入りまして、決してイエス、ノーでできない。そして十分な説明をしないと、ちょっとわからない話がきます。でも、ここから逃げるわけにはいかないというのが、ゲノムを語るときに大事なことかと思います。
さて、ヒトゲノムと多様性が扱えるようになった、ビッグデータが扱えるようになったということで、それが暮らしにいったいどう役立っていくのかということです。
いろんな応用については、それがやっていいことなのか、悪いことなのか、好ましいことなのかどうなのか。いろんな議論がありますけど、まずはそれに言及せずに、こういうことが今はできるようになっている、できるようになろうとしているということをお話していこうと思います。
患者に最適な治療を選択するPrecision Medicine
今年の1月にオバマ大統領がPrecision Medicine(プレシジョン・メディスン)という政策を発表しました。日本語に訳すと、直訳して精密医療とか的確医療という翻訳をなされているようです。
ゲノムの情報を使って、さらにゲノムを読んでいくだけじゃなくて、それを的確に集約して、分類して、それを個人個人の患者さんの医療に役立てようという考え方です。
例えば、がんのPrecision Medicineを考えると、がんはゲノムの病気ですから、病巣、病期ごと、時期ごとに、どんどんばらつきがある。ゲノムを解析して、より有効で副作用が少なくて、よく効く治療法を選択しよう。
あるいは自分が専門としてる未診断、希少疾患の精密医療としては患者さん、家族のゲノムを解析する。そして、その家族だけじゃない、複数の家族の情報を集めていく。それもできれば国際的に。そして正確な診断につなげて、治療法を選んだり、やっぱり希少な疾患ですから、新たな治療法を開発していくという方向性です。
また、ちょっとこれはさっきのPrecision Medicineと別の話になります。みなさんお聞きしたことがあるかもしれませんが、消費者向けのゲノムの解析サービスというのが出てきました。唾液を取って送って、その解析結果を返してくれるというサービスです。
注意しなきゃいけないのは、ここで返してくる解析結果というのは現時点における、個人ではなくて大規模な集団を対象とした研究成果を使って返してきてるということです。
現時点と言ってるということは、これからもどんどん研究が進んでいきます。集団も大きくなったり、あるいは日本人を使ったものが出てきたり、そしてあるときは、こう言われてたんだけれども、実はそれは否定されてますっていうことが起きてきます。
どんどん結果や解釈が変わってくというのは、ちょっと頭に入れておいたほうがいいと思います。
また、出てくるリスクですね。リスクって、ひと言でよく言いますけれども、病気の影響と、それがどれだけの確率で起きるんだという確からしさのかけ算がリスクなんですけれども、これはなかなか説明をきちんとしないと難しい話ですので、カウンセリングとか説明を充実させることがゲノム解析サービスの大きな課題ではないかなと思っています。
無侵襲性の出生前診断
そしてだんだん話が重くなっていくんですけれども、無侵襲性の出生前診断。次世代シークエンサーがこれを可能にしたんですけれども、母体の末梢血中の、ごく微量に出てきている胎児、赤ちゃん由来のゲノムDNAを取り出すことができるようになった。
これによって胎児にダメージを与えることなく検査ができる。それも妊娠初期と。妊娠初期ということは、とりもなおさず人工妊娠中絶の可能な時期ということになります。海外での事例を見ると、出産年齢が高齢化しているにもかかわらず、ダウン症出生率が変わらない、あるいは減っている。
これは先ほどの話にもありましたけれども、(是非についての議論は)それぞれの社会で、ほかの国とかに任せることができないと思うんです。それぞれの社会で、自分たちで広く議論して方向性、考えていかなきゃいけないなと。逃げることはできないなと思います。
細胞や受精卵を使ったゲノム編集技術
そしてゲノムを読む話をどんどんしていったんですけれども、読むだけか? さっき伊藤穰一さんがCRISPR(クリスパー)という技術の話を言ってました。それがゲノム編集技術なんですけれども、ゲノム中の任意の場所をねらって変更することができるようになりました。
ただし、本当にねらったとこだけを変更することができるのか。違うところをばらばらに壊しちゃったらとんでもないことになるので、その辺はまだまだ改良していかなきゃいけないという、まだ始まったばかりの技術ですけれども。
その利用としては、がんのある変異を培養細胞で再現して、「この薬は効いた。効かない」と、患者さんを使うことなく調べることができる。あるいはマウスで希少疾患を再現することで、どのような治療法があるか、実験していくことができる。
あるいは遺伝患者さんの骨髄細胞を取り出して、そこで体外でゲノム編集をして、修正して体に戻すと。自分自身の細胞を戻すこと。こういうのは可能になるだろうと考えられます。
もちろん安全性というのは非常に考えなきゃいけないんですが、例えば遺伝病のために子どもを持つことが叶わない夫婦が、受精卵を編集して遺伝病を治して、子どもを持てるようにしようとか。
あるいは人の受精卵を編集して、頭がよくて背の高い子どもをつくろうと。これはもう完全に、今の時点ではSFです。デザイナーベイビーという話ですね。今の科学技術で背が高くて頭のいい子つくろうなんていうのは、できないことなんですけれども、でも理屈としてはできるようになる。
受精卵を使ったゲノム編集は、その結果が次の世代に受け継がれることを意味します。今は、マウスとかはいいんですけれども、ヒトの受精卵を使った応用というのは、極めて慎重にならなくてはいけないと考えられてると思います。
できることと、してよいことというのは違うんだと。違う場合があるんだということ。これはまた社会的な話になるんですけれども、考えていかなきゃいけないと思います。
そしてゲノム情報の悪用。これはずっと考えなきゃいけません。プライバシーの侵害。教育、結婚、保険、就職の差別。こういうことが起こりうるわけです。
今、自分はヒトの遺伝学をやっている、人類遺伝学をやっているものが、やはりこういうことにすごく気持ちを払うのが、かつて優生思想というものにヒトの遺伝学が加担したという苦い経験を持っているからです。
常に社会と接点を持って、ゲノム情報は人類に貢献するんだ、人の暮らしをよくするんだというのを頭にたたき込みながら、自分たち、仕事していかなきゃいけないなと思っております。
最後になりますけど、このあとのディスカッションでのキーワード。ヒトのゲノムと、あと多様性ですね、一人ひとりが少しずつみんな違う多様性。この2つを使って本当によい暮らしにできるのか、ちょっと話し合っていけたらなと思ってます。以上です。どうもありがとうございました。
(会場拍手)